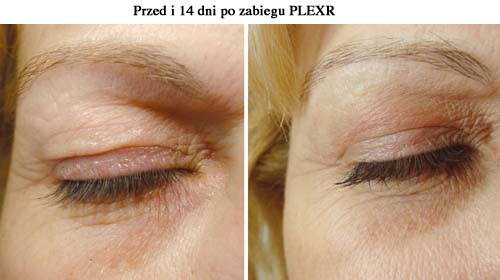
Do chwili pojawienia się urządzenia Regenera Activa i protokołu do uzyskiwania komórek progenitotowych w procesie dezagregacji skóry, tkanka tłuszczowa stanowiła jedyną tkankę miękką, z której w procesie mechanicznym pozyskiwano komórki Stromal Vascular Fraction, czyli frakcję komórek zrębu naczyń krwionośnych

Dzięki metodzie Regenera Activa mamy szansę uzyskać znacznie więcej komórek tej interesującej frakcji z mniejszej ilości tkanki i przy mniejszej traumatyzacji pacjenta. Dzięki temu z mniejszej ilości pobranego mikro przeszczepu uzyskujemy więcej interesujących nas komórek regeneracyjnych.
Komórki regeneracyjne w skórze
System Regenera Activa i protokół terapeutyczny, którym się posługujemy został opracowany do metody mikroprzeszczepu komórek; mikroprzeszczep jest w tym przypadku bardzo małą częścią autologicznej skóry (pobieramy biopsję o średnicy 2,5 mm), która zawiera komórki pochodzące z frakcji
zrębu naczyń krwionośnych, czynniki wzrostu i dodatkowe białka macierzy międzykomórkowej, przypominające fizjologiczną regeneracyjną niszę skóry.

Należy pamiętać, że nie jest to metoda izolacji komórek progenitorowych. Po procesie obróbki pobranego materiału uzyskujemy pełną frakcję komórek z całego przekroju skóry. Dokładnie zbadaliśmy jakie komórki ze skóry jesteśmy w stanie odzyskać, ile komórek odzyskujemy (80% komórek z całej skóry) i jaka jest ich przeżywalność (92%) przy zastosowaniu metody Regenera Activa.
Frakcja komórek, która jest dla nas najbardziej interesująca to Stromal Vascular Fraction czyli komórki zrębu naczyń krwionośnych, do których zaliczamy, m. in. perycyty, endotelialne komórki progenitorowe, mezenchymalne komórki macierzyste (MSC). W skórze jest jednak znacznie więcej frakcji komórek progenitorowych, z których najbardziej interesujące są komórki z okolic mieszka włosowego, z gruczołów łojowych i potowych, neomelanocyty oraz mezenchymalne komórki macierzyste (MSC).
Stromal Vascular Fraction (SVF)
W przeszłości uważano, że proces regeneracji śródbłonka i tworzenie nowych naczyń u osób dorosłych zachodzi tylko w procesie angiogenezy, gdzie naczynia są tworzone dzięki migracji i różnicowaniu in situ dojrzałych komórek endotelium. Sądzono, że waskulogeneza, proces, w którym nowe naczynia powstają z niezróżnicowanych angioblastów lub endotelialnych komórek progenitorowych zachodzi tylko w czasie embriogenezy.
Odkrycie krążących komórek progenitorowych śródbłonka – EPC przez Asaharę i wsp. W 1997 roku, całkowicie zmieniło ten pogląd. EPCs uczestniczą w postnatalnym procesie waskulogenezy przez osadzenie się w naczyniach, różnicowanie, migrację i tworzenie nowych naczyń. EPCs odgrywają rolę w tym procesie nie tylko jako podstawowe komórki do tworzenia nowych naczyń, ale również poprzez wpływ na sąsiednie komórki w sposób parakrynny.
Perycyty będące multipotencjalnymi komórkami macierzystymi współtworzą ściany naczyń krwionośnych włosowatych oraz przed– i pozawłosowatych. Komórki są umiejscowione pod błoną podstawną, ściśle przylegając do komórek śródbłonka. Do najczęściej wymienianych markerów molekularnych perycytów należy NG2 (neural-glial antigen 2), receptor płytkopochodnego czynnika wzrostu β (PDGFRβ, β-type platelet-derived growth factor receptor), α-aktyna mięśni gładkich, białko regulujące RGS5 (regulator of G protein signalling 5), białko adhezyjne CD146 oraz nestyna.
Perycytom przypisuje się różne funkcje w procesach fizjologicznych, takich jak utrzymanie integralności i stanu spoczynkowego komórek śródbłonka, regulacja napięcia naczyń krwionośnych, czy też potencjał do różnicowania w inne komórki. Perycyty, podobnie jak inne komórki, np. mezenchymalne komórki macierzyste (MSCs; mesenchymal stem cells), mogą oddziaływać parakrynnie: przez wydzielanie czynników wzrostu, cytokin i uwalnianie mikropęcherzyków zawierających białka, cząsteczki mRNA i miRNA.
Na przykład ludzkie perycyty wyizolowane z mięśni wytwarzają dużo takich czynników jak: HB-EGF, VEGF (vascular endothelial growth factor) czy HGF (hepatocyte growth factor). Poziom ich znacznie przewyższał ten charakterystyczny dla hodowli mezenchymalnych komórek macierzystych wyizolowanych z tkanki tłuszczowej czy krwi pępowinowej.
Komórki progenitorowe mieszka włosowego
Obiecującym źródłem somatycznych komórek macierzystych są mieszki włosowe. Mieszki włosowe rozwijają się jeszcze w trakcie trwania życia płodowego. Powstają na skutek oddziaływania komórek epidermalnych i mezenchymalnych. Mieszki włosowe są siedliskiem różnych populacji komórek macierzystych i stanowią główne źródło komórek odpowiedzialnych za regenerację włosów, gruczołów łojowych i naskórka.
W warunkach fizjologicznych w regeneracji naskórka uczestniczą komórki macierzyste warstwy podstawnej naskórka, dzięki którym naskórek utrzymuje zdolność do odnowy. Jednakże w przypadku wystąpienia jakichkolwiek urazów czy oparzeń całkowicie uszkodzony naskórek regenerują nabłonkowe komórki macierzyste mieszków włosowych. W wielu badaniach potwierdzono, iż w obrębie mieszka włosowego znajdują się także inne populacje komórek macierzystych.
Drugą ważną grupą komórek macierzystych są mezenchymalne komórki macierzyste, które zlokalizowano w torebce włóknistej i w brodawce włosa. Mają one potencjał do regeneracji nie tylko komórek hematopoetycznych, lecz mogą także różnicować się w komórki tłuszczowe, mięśniowe czy kostne.
W obrębie mieszka włosowego obecne są również komórki o potencjale zbliżonym do komórek embrionalnych – są to komórki wywodzące się najprawdopodobniej z grzebienia nerwowego. Komórki te wykazują ekspresję nestyny i są zdolne do regeneracji m.in. neuronów, komórek glejowych jak i melanocytów.
Regenera Activa. Regeneracja
Każdy mikroprzeszczep zastosowany w metodzie Regenera Activa stanowi niszę regeneracji, która po infiltracji obszaru dotkniętego chorobą może nie tylko proliferować i tworzyć nową macierz dla siebie, ale także pobudzać otaczające środowisko do regeneracji i odbudowy utraconej aktywności ze szczególnym uwzględnieniem procesów neoangiogenezy.
W literaturze naukowej nie znajdziemy odpowiedzi na pytanie ile komórek progenitorowych potrzebujemy do uzyskania konkretnego efektu terapeutycznego. Należy pamiętać, że mówimy o metodach medycyny regeneracyjnej. W przypadku każdego pacjenta poziom odzyskania komórek z mikro-przeszczepu będzie inny, każdy pacjent ma również inne zdolności regeneracyjne, i wreszcie u każdego z nich poziom zaawansowania procesu chorobowego jest inny.
Wiemy natomiast, że liczba komórek, którą jesteśmy w stanie wyizolować z jednego mikro-przeszczepu to około 80 tys. Pobierając trzy biopsje mamy więc do dyspozycji około 240 tys. komórek, która to liczba, jak wynika z danych klinicznych jest w stanie przynieść znakomite efekty kliniczne.
Autorki: Dr n. med. Magdalenia Dembińska, dermatolog, PRODERMA (Poznań); lek. med. Małgorzata Kocot, dermatolog, IKONA CITY (Gliwice);
Źródło: Revisage
Literatura:
Chen C.W., Montelatici E., Crisan M., Corselli M., Huard J., Lazzari L., Péault B.: Perivascular multi-lineage progenitor cells in human organs: regenerative units, cytokine sources or both? Cytokine Growth Factor Rev., 2009; 20: 429-434
Birbrair A., Zhang T., Files D.C., Mannava S., Smith T., Wang Z.M., Messi M.L., Mintz A., Delbono O.: Type-1 pericytes accumulate after tissue injury and produce collagen in an organ-dependent manner. Stem Cell Res. Ther., 2014; 5: 122
Jahoda C.A., Reynolds A.J.: Hair follicle dermal sheath cells: unsung participants in wound healing. Lancet, 2001; 358: 1445–1448
Lako M., Armstrong L., Cairns P.M., Harris S., Jahoda C.A.: Hair follicle dermal cells repopulate the mouse haematopoietic system. J. Cell. Sci., 2002; 115: 3967–3974
Rochat A., Kobayashi K., Barrandon Y.: Location of stem cells of human hair follicles by clonal analysis. Cell, 1994; 76: 1063–1073
Trovato L., Monti M., Del Fante C., „ A New Medical Device Rigeneracons Allow to Obtain Viable Micro-Grafts from Mechanical Disaggregation of Human Tissues”, Journal of Cellular Physiology, 2015, 230, 2229-2303
Zantoretta F., Laverazzi E., Trovato L., Adipse Derived Stem Cells And Growth Factors Applied on Hair Transplatation. Follow-Up of Clinical Outcome”, Journal of Cosmetics, Dermatological Science and Applications, 2014, 4, 268-274
Purpura V., Bondlioli E., Graziano A., Trovato L., Melandri D., Ghetti M., Tissue Characterization after a New Disaggregation Method for Skin Micro-Grafts Generation. J. Vis. Exp. (109), e53579, doi: 10.3791/53579 (2016)
Giaccone M, Brunetti M, Camandona M, Trovato L, Graziano A. A Ne Medical Device, Based on Rigenera Protocol, in the management of Complex Wounds. J Stem Cells Res, Rev & Rep. 2014;1(3):3.