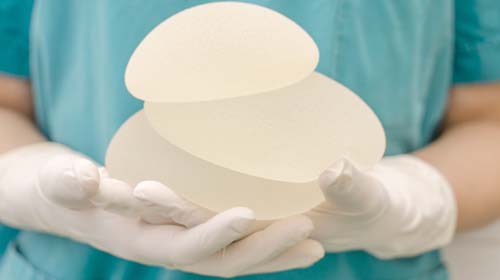
Amerykańska Agencja ds. Żywności i Leków (FDA – The US Food and Drug Administration) pozwoliła kontynuować sprzedaż teksturowanych implantów. Jednak regulatorzy w wielu innych krajach zdecydowali się na zakaz sprzedaży tego typu wyrobów medycznych lub restrykcje związane z ich wprowadzaniem na rynek ze względu na wątpliwości, dotyczące ich związku z występowaniem bardzo rzadkiego nowotworu
– Na chwilę obecną FDA nie uważa, aby na podstawie wszystkich dostępnych danych i informacji sytuacja z implantami spełniała warunki nałożenia zakazu sprzedaży, określone w Federalnej Ustawie o Żywności Lekach i Kosmetykach – oświadczyli 3 maja b.r. dr n. med. Amy Abernethy, zastępca komisarza FDA i dr n. med. Jeff Shuren, dyrektor Centrum Urządzeń i Zdrowia Radiologicznego FDA.
Amerykański portal medyczny Medscape.com przypomina, że niektóre kraje podjęły ostrzejsze kroki niż FDA. W grudniu 2018 r. Allergan podjął decyzję o wstrzymaniu sprzedaży teksturowanych implantów na rynkach europejskich. Stało się to po tym, jak francuskie organy nadzorcze zapowiedziały możliwość wycofania produktów z rynku.
Restrykcje we Francji
Jak podaje tvn24bis.pl francuska Narodowa Agencja ds. Leków i Produktów Zdrowotnych (ANSM) poinformowała 2 kwietnia 2019 r producentów o swoich planach, dotyczących: „zakazu produkcji, dystrybucji, importu, eksportu, promocji, noszenia teksturowanych oraz poliuretanowych implantów piersi”.
Wskazuje ona na: „rzadkie, ale poważne niebezpieczeństwo”, które mogą powodować implanty. Jest nim anaplastyczny chłoniak wielkokomórkowy (BIA-ALCL), rzadka postać raka. ANSM poinformowała w listopadzie 2018 r., że od 2011 roku zarejestrowała 53 przypadki BIA-ALCL.
FDA będzie badać sprawę
FDA poinformowała m. in. że od marca 2019 r. implanty teksturowane firmy BioCell zostały wycofane we wszystkich 33 krajach europejskich, a także w Izraelu i Brazylii. Na początku kwietnia 2019 r. urząd Health Canada rozważał zakaz tego typu produktów.
FDA zapowiada, że podejmie kroki w celu zgłębienia informacji na temat ewentualnego podwyższonego ryzyka związanego z implantami teksturowanymi. Medscape.com zwraca uwagę, że w ostatnich miesiącach wątpliwości wokół nich narastają, ponieważ FDA w lutym 2019 r. zanotowała więcej niepokojących przypadków i zaplanowała specjalne posiedzenie, dotyczące tej kwestii. Podczas tego spotkania niektórzy naukowcy sugerowali, że bakterie i biofilm na implantach piersi mogą sprzyjać rozwojowi nowotworu (BIA-ALCL).
Jak informowała FDA w majowym oświadczeniu, agencja rozważa podjęcie kroków, które mają doprowadzić do zwiększenia świadomości lekarzy i pacjentów na temat ryzyka, związanego z implantami piersi. Wśród nich wymienia się np. ostrzeżenia na opakowaniach produktów oraz stworzenie listy obowiązkowych informacji, które ma zawierać zgoda pacjenta na zabieg.
To nie koniec kłopotów
FDA poszukuje również sposobów skutecznego odpowiadania na dolegliwości kobiet, które zgłaszają problemy zdrowotne takie jak: chroniczne zmęczenie, problemy poznawcze, bóle stawów i mięśni, łącząc je z implantami piersi.
– Jak do tej pory FDA nie ma ostatecznych dowodów na to, że to implanty są powodem tych dolegliwości, jednak dostępne informacje wskazują, że niektóre kobiety doświadczają objawów ogólnoustrojowych, które mogą ustępować po usunięciu protez piersi – mówili w majowym oświadczeniu dr Amy Abernethy i dr Jeff Shuren z FDA.
– Niektórzy pacjenci i osoby z personelu medycznego określają to zjawisko jako chorobę implantów piersi – przyznali.
Źródło: FDA, Medscape.com, tvn24bis.pl/rynekestetyczny.pl