URPL opublikował na początku stycznia dwie notatki bezpieczeństwa, dotyczące produktów iniekcyjnych wykorzystywanych w medycynie estetycznej.
Producenci wyrobów medycznych mają obowiązek zgłosić do Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych (URPL) każde zewnętrzne działania korygujące, dotyczące bezpieczeństwa, związane z wyrobami udostępnionymi na rynku w Polsce.
Zewnętrzne działanie korygujące dotyczące bezpieczeństwa (FSCA – Field Safety Corrective Action) oznacza działanie podjęte przez producenta z powodów technicznych lub medycznych w celu zapobieżenia ryzyku wystąpienia poważnego incydentu związanego z wyrobem udostępnionym na rynku lub w celu ograniczenia takiego ryzyka.
Prezes Urzędu analizuje adekwatność planowanych lub podjętych przez producenta działań i sprawuje nadzór nad tymi działaniami. W celu realizacji FSCA producent sporządza notatkę bezpieczeństwa (FSN – Field Safety Notice), czyli komunikat, który przesyła do użytkowników lub klientów.
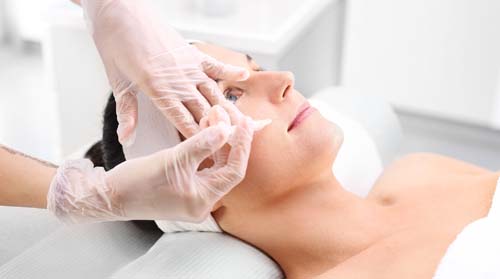
Nie w okolicy oczu
 Z notatki bezpieczeństwa (FSN) firmy VAIM Co. Ltd., opublikowanej 9 stycznie przez URPL, dowiadujemy się, że nie należy stosować preparatu Juvelook w okolicy okołooczodołowej.
Z notatki bezpieczeństwa (FSN) firmy VAIM Co. Ltd., opublikowanej 9 stycznie przez URPL, dowiadujemy się, że nie należy stosować preparatu Juvelook w okolicy okołooczodołowej.
Według opinii Polskiej Agencji ds. Produktów Leczniczych, w instrukcji użytkowania preparatu brakuje klarownego opisu obszaru, w który należy podać wyrób medyczny, oraz wyraźnego wyznaczenia stref bezpiecznych i niebezpiecznych. Stwierdzono, że analizowana reakcja niepożądana, została spowodowana brakiem jasnych, istotnych informacji w instrukcji użytkowania.
Producentowi zalecono zmianę instrukcji. Podkreślono, że produkt musi być stosowany przez chirurga plastycznego, dermatologa lub wykwalifikowanego lekarza. Notatka bezpieczeństwa opublikowana jest na stronie URPL. Dostępna jest również do ściągnięcia obok.
Uwaga: podrobione produkty
 Kolejna notatka bezpieczeństwa firmy VAIM Co. Ltd, którą publikuje URPL, dotyczy podrobionych wyrobów medycznych Etrebelle oraz Reversal do śródskórnej i podskórnej implantacji, zawierających kwas polimlekowy PDLLA i kwas hialuronowy HA.
Kolejna notatka bezpieczeństwa firmy VAIM Co. Ltd, którą publikuje URPL, dotyczy podrobionych wyrobów medycznych Etrebelle oraz Reversal do śródskórnej i podskórnej implantacji, zawierających kwas polimlekowy PDLLA i kwas hialuronowy HA.
Firma ostrzega, że produkty Etrebelle sprzedawane na rynku są albo przeterminowane, albo nie są produkowane przez VAIM. Z potwierdzonych informacji wynika, że produkty Reversal są dystrybuowane wyłącznie z datą ważności styczeń 2025. Jeśli istnieją takie produkty z datą ważności dłuższą, nie są one produkowane przez VAIM.
W dokumencie podkreślono, że: “Podróbki stwarzają niedopuszczalne ryzyko“. Notatka bezpieczeństwa opublikowana jest na stronie URPL. Dostępna jest również do ściągnięcia obok.
Źródło: URPL / Rynek estetyczny