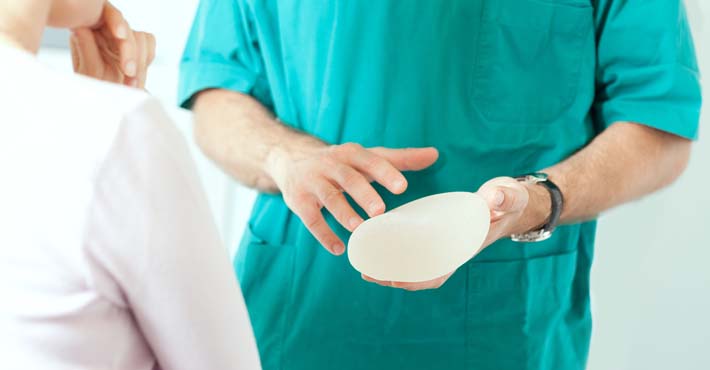
Przepisy Rozporządzenia Parlamentu Europejskiego i Rady (UE) 2017/745 w sprawie wyrobów medycznych, czyli w skrócie MDR (Medical Devices Regulation), zaczęły obowiązywać 26 maja b.r. Gdyby nie pandemia weszłyby w życie rok wcześniej. Uchwalono je już w 2017 r. i wyznaczono 3-letnie vacatio legis. Zdaniem ekspertów MDR będą miały istotny wpływ także na rynek medycyny estetycznej. Jednak mało kto wie, że wszystko zaczęło się od światowej afery z wadliwymi implantami piersi, której początki sięgają 2010 r. i którą szeroko opisywaliśmy w „Rynku estetycznym”
– Mówi się, że kołem napędowym dla stworzenia nowej regulacji europejskiej były m.in. incydenty z pękającymi implantami piersi we Francji. Z tym też wiązałbym rozszerzenie omawianej regulacji o tego typu produkty – mówił w rozmowie z „Rynkiem estetycznym” w 2018 r. Witold Włodarczyk, ówczesny dyrektor generalny Ogólnopolskiej Izby Gospodarczej Wyrobów Medycznych POLMED. Miał rację. Już w 2013 r. Parlament Europejski zapowiadał zaostrzenie przepisów, dotyczących wyrobów medycznych.
Parlament Europejski o zaostrzeniu przepisów
Jak informowaliśmy w portalu rynekestetyczny.pl Parlament Europejski (PE) 22 października 2013 r. opowiedział się za zaostrzeniem przepisów, dotyczących wyrobów medycznych najwyższej klasy ryzyka. Chodziło m. in. o implanty piersi, a także rozruszniki serca, protezy, czy testy. Było to pokłosie afery z wadliwymi implantami francuskiej firmy Poly Implant Prothese (PIP).
Dokładniejszy monitoring i procedury certyfikacji, które mają zapewnić możliwości śledzenia wadliwych wyrobów medycznych, takich jak implanty piersi – to regulacje, które zostały zaproponowane 22 października przez PE. Był to prototyp MDR. To wówczas rozpoczęły się negocjacje tych rozwiązań między przedstawicielami europarlamentu a państwami członkowskimi.
Relacjonowaliśmy wtedy informacje przekazywane przez Parlament Europejski, z których wynikało, że celem nowych przepisów miała być poprawa przejrzystości informacji, które udzielane są pacjentom oraz personelowi medycznemu przez producentów wyrobów medycznych najwyższej klasy ryzyka. W proponowanych nowych regulacjach chodziło też o zapewnienie lepszych możliwości śledzenia wyrobów medycznych, jednocześnie bez nakładania dodatkowych obciążeń na małych innowacyjnych przedsiębiorców.
PE zwracał wówczas uwagę, że w obliczu niedawnych skandali, w wyniku których liczba pacjentów, którzy posiadali wadliwe implanty była niemożliwa do ustalenia, europosłowie chcieli, aby pacjenci otrzymywali kartę implantu oraz byli rejestrowani. Zdaniem PE dzięki temu byliby ostrzegani, w razie pojawienia się informacji o wykrytych nieprawidłowościach.
Już wówczas jesienią 2013 r. w związku z aferą PIP Komisja Europejska (KE) zdecydowała, że zakłady, produkujące wyroby medyczne, które są zaliczone do wyższej klasy ryzyka – właśnie takie jak implanty piersi, stosowane w chirurgii plastycznej – będą poddawane niezapowiedzianym kontrolom.
Nawet 500 tys. kobiet z wadliwymi implantami
Jak pisaliśmy w portalu rynekestetyczny.pl i w magazynie „Rynek estetyczny” wadliwe implanty piersi francuskiej firmy Poly Implant Prothese (PIP) wszczepiono, według różnych szacunków, od 300 do 500 tys. kobietom w 65 krajach na całym świecie. Zanotowano ponad 4 tys. przypadków ich pęknięcia. Wiele kobiet poddało się prewencyjnym operacjom usunięcia szkodliwych implantów.
Jean-Claude Mas, były prezes PIP, przyznał podczas przesłuchania we Francji (na początku 2012 r.), że do produkcji protez piersi wykorzystywany był żel silikonowy bez atestów medycznych. Cała sprawa zaczęła się skandalem na skalę światową, który wybuchł w 2010 r. To wówczas wyszło na jaw, że francuska firma używała do produkcji implantów piersi silikonu przemysłowego zamiast medycznego, co później potwierdził jej prezes w zeznaniach.
PIP przestało istnieć właśnie w 2010 r. Proces szefów firmy, który rozpoczął się 17 kwietnia 2013 r., odbywał się w centrum kongresowym w Marsylii, ze względu na bardzo dużą liczbę skarżących. Pozwy złożyło w sumie 7113 kobiet. Wyrok skazujący zapadł 10 grudnia 2013 r. Poza karą czterech lat więzienia 74-letni wówczas Jean-Claude Mas musiał zapłacić grzywnę w wysokości 75 tys. euro. Miał również zakaz aktywności w sektorze medycznym oraz zakaz zakładania działalności gospodarczej. Ukarani zostali także inni członkowie kierownictwa francuskiej firmy. Troje skazano na kary trzech lat więzienia. Kolejna osoba dostała półtora roku w zawieszeniu.
Wątpliwa rola instytucji certyfikujących
(…)
(Cały artykuł dostępny w e-Wydaniu „Rynku estetycznego”)
Chcesz wiedzieć więcej?
Ten i wiele innych ciekawych artykułów nt. medycyny estetycznej do przeczytania w numerze „Rynku estetycznego”.
Prenumeratorów zapraszamy do korzystania z e-WYDANIA